Наиболее важные гетероциклы
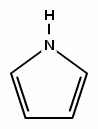
Пиррол представляет собой бесцветную жидкость, напоминающую по запаху хлороформ, медленно темнеющую при стоянии на воздухе. Он слегка гигроскопичен, немного растворим в воде и хорошо растворим в большинстве органических растворителей. Структуру пиррола предложил в 1870 г. Байер, основываясь на его окислении хромовой кислотой в малеинимид и образовании его при перегонке сукцинимида с цинковой пылью.
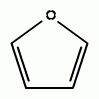
Бесцветная горючая жидкость с запахом хлороформа, tкип 31,33°C. Фуран — промежуточный продукт в синтезе тетрагидрофурана, используется также для получения пиррола (реакцией с NH3 в присутствии Al2O3).
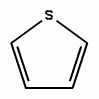
Тиофен относится к π-избыточным гетероароматическим системам и обладает выраженными ароматическими свойствами. В реакциях электрофильного замещения (галогенирование, нитрование, формилирование, дейтерирование и др.) тиофен значительно активнее бензола (в некоторых случаях в 104 раз). Реакции идут обычно (иногда исключительно) в α-положение цикла (на 2—3 порядка быстрее, чем в др. положение).
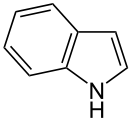
Органическое соединение ряда азотсодержащих гетероциклов. Является родоначальником широкого класса природных соединений. Состоит из конденсированных бензольного (6 атомов углерода) и пятичленного пиррольного ядра, содержащего в цикле один атом азота. Содержится в каменноугольной смоле, в некоторых эфирных маслах (например в масле жасмина). Индол служит исходным сырьем для синтеза гетероауксина триптофана, используется в парфюмерной и фармацевтической промышленности.
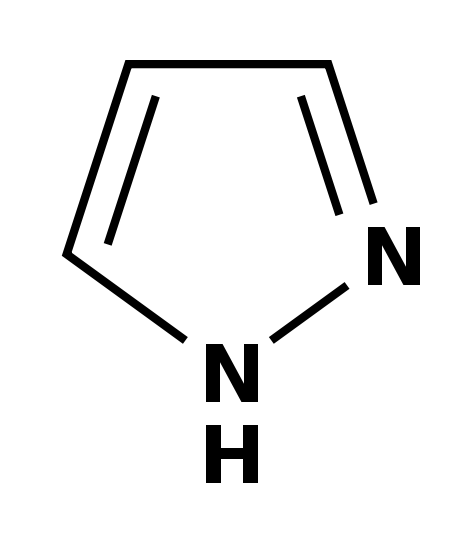
Бесцветные кристаллы, tпл 70 .С. Многие производные пиразола - лекарственные препараты (напр., амидопирин), красители, гербициды.
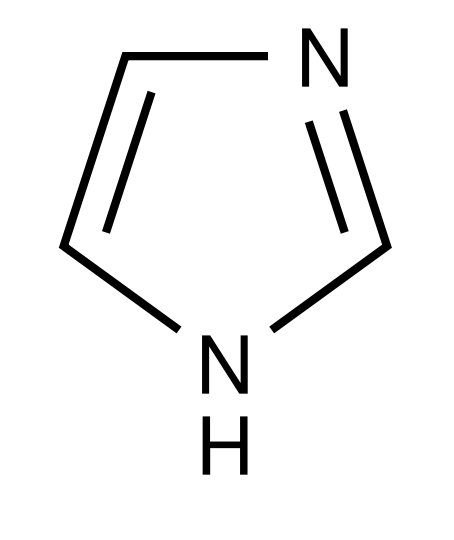
Органическое соединение класса гетероциклов, пятичленный цикл с двумя атомами азота и тремя атомами углерода в цикле, изомерен пиразолу. В незамещенном имидазоле положения 4 и 5 (атомы углерода) равноценны, вследствие таутомерии. Ароматичен, реагирует с солями диазония (сочетание). Нитруется и сульфируется только в кислой среде в положение 4, галогены в щелочной среде вступают по положению 2, в кислой - по положению 4. Легко алкилируется и ацилируется по иминному N, раскрывает цикл при взаимодействии с растворами сильных кислот и пероксидов. Катализирует гидролиз трудноомыляемых сложных эфиров и амидов карбоновых кислот. Имидазольный цикл входит в состав незаменимой аминокислоты гистидина. Структурный фрагмент гистамина, пуриновых оснований, дибазола.
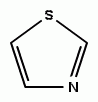
Органическое гетероциклическое соединение, содержащее азот и серу; входит в состав некоторых биологически активных веществ, например тиамина, пенициллинов. Бесцветная жидкость, tкип 116,8 °С. Структурный фрагмент кофермента тиамина (витамина В..1) и многих лекарственных средств.
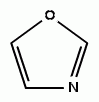
Представляет собой 6p-электронную ароматическую систему. Оксазол и его замещенные устойчивы к щелочам. с сильными кислотами образуют по атому N непрочные соли. под действием окисли телей (КМnО4, К2Сг2О7) и горячих неорг. кислот раскрывают цикл с образованием a-ациламинокарбониль-ных соединений.
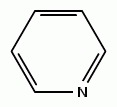
Шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения. Получают из каменноугольной смолы. Применяют в синтезе красителей, лекарственных веществ, инсектицидов, в аналитической химии, как растворитель многих органических и некоторых неорганических веществ, для денатурирования спирта. Пиридин токсичен, действует на нервную систему, кожу.
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда. В тоже время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит у серьёзному перераспределению электронной плотности, что приводит к сильному снижению активности пиридина в реациях электрофильного ароматического замещения. В таких реакциях реагируют преимущественно мета-положения кольца. Для пиридина характерны реации ароматического нуклеофильного замещения,протекающие преимущественно по орто-пара положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
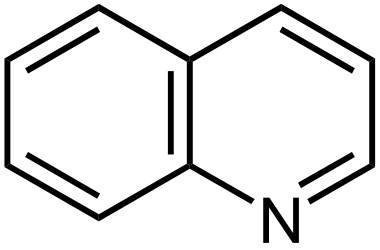
Органическое соединение гетероциклического ряда. Применяют как растворитель для серы, фосфора и др., для синтеза органических красителей. Производные хинолина, используют в медицине (плазмоцид, хинин).
Хинолин в природе встречается в составе каменноугольной смолы, из которой и добывается.
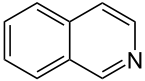
Бесцветные кристаллы со слабым запахом миндаля;Тпл=24,5 °С, Ткип=243 °С. Изохинолин плохо растворим в холодной воде, в органических растворителях — хорошо. Он содержится в небольшом количестве в каменноугольном дёгте, откуда его выделяют вместе с хинолином. Изохинолин — более сильное основание, чем хинолин.
При протонировании изохинолин образует соли изохинолиния; с алкил-, ацил-, арилгалогенидами и диметилсульфатом образует четвертичные соли.
При гидрировании над платиной превращается в 1,2,3,4-тетрагидроизохинолин; при полном гидрировании - в цис-декагидроизохинолин.
Окисление смесью озона и кислорода приводит к пиридин-3,4-дикарбоновой кислоте, окисление пероксокислотами ведёт к изохинолин-N-оксиду.
Реакции электрофильного замещения происходят в положении 5. Бромирование легче протекает в присутствии AlCl3, нитрование идёт при действии серной и азотной кислот. Сульфирование при действии 40%-ного олеума при температуре 180оС приводит обычно к изохинолин-8-сульфокислоте. Сульфирование 60%-ной серной кислотой при 300оС ведёт к смеси изохинолин-5- и изохинолин-8-сульфокислот.
При высокой температуре изохинолин вступает в реакции бромирования по радикальному механизму с образованием 1-бромизохинолина.
Нуклеофильное замещение протекает как правило в положение 1. С гидроксидом калия при 200оС изохинолин образует 1-гидроксиизохинолин, с амидом натрия - 1-аминоизохинолин.
Важнейший метод получения изохинолина и его производных — циклодегидратация β-фенилэтиламидов кислот C6H5CH2CH2NHCOR (реакция Бишлера — Напиральского) с последующим дегидрированием образующихся 3,4-дигидроизохинолинов. Другие методы синтеза изохинолина и его производных: метод Померанца — Фрича (конденсация ацетофенона с а-аминоацетацеталем); метод Пикте — Шпенглера; по реакции Бишлера-Напиральского.
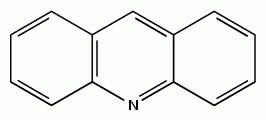
Слабое основание (рКа 5,6 при 20 °С, в воде). Обладает ароматич. свойствами. Обратимо димеризуется на свету. Легко восстанавливается в акридан (9,10-дигидроакридин) амальгамой Na, Zn в НС1 и на никеле Ренея. Под действием КМnО4 в щелочной среде и при озонолизе в спирте окисляется в 2,3-хинолиндикарбоновую кислоту, надбензойной кислотой-в N-оксид, способный, подобно N-оксиду пиридина, к реакциям замещения. При нагр. с S в запаянной трубке при 190°С образуется 9-тиоакридон, при взаимод. с сильными минер. кислотами-хорошо кристаллизующиеся соли акридиния (аналогичные пиридиниевым и хинолиниевым), легко подвергающиеся нуклеоф. атаке в положение 9. В реакции электрофильного замещения вступает с трудом и неоднозначно, поэтому замещенные обычно получают из акридона. При нитровании образуется смесь изомерных нитроакридинов с преимущественным содержанием 2-нитроакридина. В реакции с Вr2 в ССl4 образуется N-бромакридинийбромид, в СН3СООН-2-бром- и 2,7-дибромакридин.
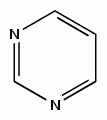
Проявляет свойства слабого двукислотного основания, т.к. атомы азота могут присоединять протоны за счет донорно-акцепторной связи, приобретая при этом положительный заряд.
Реакционная способность в реакциях электрофильного замещения у пиримидина снижена из-за снижения электронной плотности в положениях 2,4,6, вызванного наличием двух атомов азота в цикле. Замещение становится возможным только при наличии электронодонорных заместителей и аправляется в наименее дезактивированное положение 5. Однако в противовес этому пиримидин активен по отношению к нуклеофильным реагентам, которые атакуют 2, 4 и 6 атомы углерода в цикле.
Производные пиримидина широко распространены в живой природе, где участвуют во многих важных биологических процессах. В частности такие производные как цитозин, тимин, урацил входят в состав нуклеотидов, являющихся структурными единицами нуклеиновых кислот, пиримидиновое ядро входит в состав некоторых витаминов группы B, в частности B1, коферментов и антибиотиков.
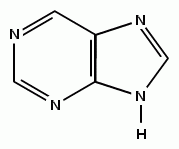
Гетероциклическое соединение, простейший представитель имидазо[4,5-d]пиримидинов.
Производные пурина играют важную роль в химии природных соединений (пуриновые основания ДНК и РНК; кофермент NAD; алкалоиды, кофеин, теофиллин и теобромин; токсины, сакситоксин и родственные соединения; мочевая кислота) и, благодаря этому, в фармацевтике.
